
本文来自 DeepTech 深科技(微信:mit-tr)
随着人类基因组计划的完成,人类医学正在迈入一个新的时代。一大波卓越的医学突破和金融投资将引领一个全新的个性化精准医疗时代。
「每个病人都是独一无二的,医生们一直都在极尽所能去因人用药。就像你要输血,血型一定要匹配,这是一个非常重要的发现。如果我们将个体的遗传密码与癌症进行『配型』,并作为切实可行的标准,我们决定药物的剂量,将如同测量我们的体温一样方便——这就是精准医疗给我们带来的希望。」
——奥巴马,2015 年 1 月 20 日
美国总统奥巴马在 2015 年国情咨文演讲中宣布,美国将投资 2.15 亿美元启动一项名为「精准医疗」(Precision Medicine,PM)的计划,将精准医疗作为一项国家战略轰轰烈烈地带入了大众的视野。
所谓精准医疗,即是一种基于病人个体信息「量身定制」的新型医疗模式。在这种模式下,医疗的决策、实施等都是针对病患个体化特征而制定的,疾病的诊断和治疗也是在患者个体化基因信息结合其个体环境、生活方式和健康史等大数据信息的基础上进行的。
- 开篇 新时代的医疗奇迹
- 大问题 蓬勃发展,但进展缓慢的精准医疗
- 时间线 精准医疗的先驱
- 案例研究 基因数据全球化变局
- Q&A「医疗自拍」的时代即将来临
- 大问题 科研和资本的一场豪赌
- 案例研究 大规模制造 DNA 时代将提前降临
新时代的医疗奇迹
初生的婴儿应该无忧无虑的享受新生世界的美好,然而并不是每一个婴儿都如此幸运。
2015 年 7 月 25 日,卡瑞娜 (Carina) 像无数新生儿一样带着响亮的哭声降临在这个世界,然而她下巴的一个小肿块注定了她的命运有所不同。
最初医生并未确诊,但随后发现这是一个恶性肿瘤。仅仅 1 岁半的卡瑞娜,就已经接受了 8 轮的化疗和手术。
面对顽固的肿瘤再一次不可抑制的增长,卡瑞娜的父母心力交瘁,无计可施。放疗可能会有所帮助,但其对大脑的损害让这对新生父母望而却步。
医生建议他们尝试任何有可能的试验药物。
对肿瘤的基因测试显示,卡瑞娜有 2 个基因序列发生了异常的融合导致了肿瘤。卡瑞娜的肿瘤医生拉玛莫西(Ramamoorthy)找到了一种临床试验药物能够干预这类基因融合所合成的蛋白,但该药物目前只针对成人。
随后,拉玛莫西医生和药物制造商 Loxo Oncology 向美国 FDA 申请了儿童临床试验。去年 12 月,卡瑞娜成为了第一个参试病人。
肿瘤最初像核桃一样大,经过 28 天的治疗后,肿瘤几乎全部不见了。虽然卡瑞娜还要继续服用药物,肿瘤也可能再次变异而重来,但现在的卡瑞娜就是一个活泼可爱的两岁孩子。
卡瑞娜的爸爸感激地说:这次治疗让我们一家人重获了快乐。
卡瑞娜以及其他相似的病例的成功,就是得益于精准医疗。
精准医疗是生物技术和信息技术在医学临床实践的交汇融合应用,结合不同来源的大数据信息,针对个体建立个性化、针对性的有效治疗方案。
但这完全不同于现有的医疗模式选择适用于大多数患者的通用治疗方案。比如,纽约市的史隆凯特琳癌症研究中心(Memorial Sloan Kettering Cancer Center)作为该领域领头,自 2014 年起对 1 万例肿瘤进行基因测序,以供肿瘤专家开发设计个性化肿瘤治疗方案。
蓬勃发展,但进展缓慢的精准医疗
任何的改革和转型都会遭遇挑战。精准医疗的发展需要面对来自从医疗行业到新药研发等各领域的挑战。
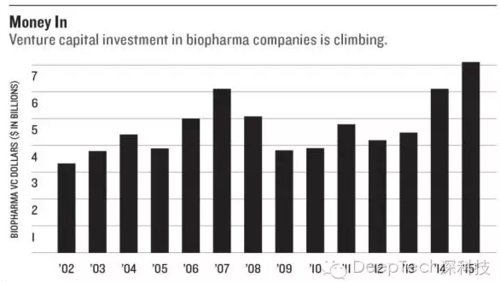
据硅谷银行的数据显示,风险投资公司去年向全美的生物医药创业公司豪掷 70 亿美元(见上图)。这股热情多是看到了基因药物与相关技术的突破性进展。
Loxo Oncology 公司新型药物的成功,正体现了小公司所发挥作用。Loxo 创始人 Joshua Bilenker 称公司的发展受益于众多的公共大数据信息,比如国家卫生研究院癌症基因组图谱(National Institutes of Health’s Cancer Genome Atlas)等。
随着私募基金和公募基金的共同支持,Loxo 公司目前已获得 2.5 亿美元的投资。Bilenkers 称,Loxo 公司主要定位于相对简单的基因型癌症,言下之意,公司能够很快知道治疗方案是否有效,这也是投资者所乐于见到的。
相比于大型医药公司针对通用疾病的新药研发,这些治疗测试可以招募小团体,所以成本较小。针对通用疾病的畅销药往往需要大量、昂贵的随机试验。而类似卡瑞娜的病例,在全美国几乎不可能找到超过几千例的患者做此类试验。
这类针对性的基因药物只适用于小群体患者,不太可能成为畅销药而给公司带来大的利润。
像 Loxo 这样的公司,很可能会通过向每个患者收一大笔钱来收回投资的成本。
目前,癌症治疗的平均花费为每月 1 万美元。但过去十年里癌症药物价格膨胀,保险公司和患者都开始对价格显出担忧,因为双方承担的治疗费用都在不断增长(部分医药费用是由保险公司和病人按照不同比例共同承担的)。
同时,精准医疗当然也有技术风险。
Editas Medicine 公司一直致力于新型基因编辑 CRISPR/Cas9 研究以治疗基因组异常性疾病,预计于明年开始进行临床试验。
然而,在此之前还有很多复杂的科学问题需要完善,比如基因编辑本身以及如何有效地将药物递送至合适的细胞里。
精准医疗有望最终治疗重大疾病,但这并不容易。有些疾病非常复杂,很可能涉及多个基因组,因此难以寻找相关的对应基因组信息。
除了需要基因组信息,精准医疗也要收集患者环境、生活方式和健康史等大数据信息。
WellDoc 和 Omada 这类公司正在尝试通过移动通信设备了解并记录患者的生活和健康数据,这些数据能够帮助患者和医生找到更好的治疗切入点,特别是受慢性疾病如糖尿病和高血压折磨的患者。
波士顿学术医疗体系的医疗联盟集团倡导的「连接医疗(Connected Health)」项目负责人乔瑟夫·科伟达(Joseph Kvedar)表示,尽管一些项目取得了成功,仍有很大一部分患者并没有成为受众群体。精准医疗远没有 Snapchat、Instagram 或者 Facebook 那样深入人心。
科伟达解释说,「患病提醒当然不会像社交媒体那样受欢迎,但是我们仍有很大的机遇。当代各种社交媒体信息和移动通讯信息让每个人成为独特的个体。如果我们能够跟踪这些个性化的信息,再加上个体的基因信息,我们能够走的更远。」
就像奥巴马说的,「我们需要这些信息,使我们自己和家人更加健康。」
精准医疗的先驱
生物科技公司 Genentech 发明的赫赛汀(Herceptin)是最早的靶向基因药物,于 1998 年获得美国 FDA 批准,主要针对 HER2 蛋白过度表达的转移性乳腺癌。
自从 Genentech 公司所属的瑞士制药巨头罗氏公司(Roche)将赫赛汀推向美国以外的市场,赫赛汀目前已经治疗了全球超过两百万的患者,全球销售额已超过 640 亿美元。
将赫赛汀定义为精准医疗的先驱,当之无愧。
以下是赫赛汀的发展史:
- 1985 年 美国国家卫生研究院研究表明乳腺癌肿瘤细胞中的 HER2 基因频繁过度表达。
- 1990 年 先前克隆了人类首例 HER2 基因的 Genentech 公司科学家们,找到了一种将鼠源性抗体人源化的方法,通过基因修饰,获得人源化后的鼠抗体蛋白靶向结合癌细胞表面的 HER2,并且不引发免疫反应,至此发明了赫赛汀(Herceptin)。后来第三方估计 Gnentech 的研发成本为 1.5 亿到 2 亿美元。
- 1992-1998 年 进行临床试验已验证赫赛汀的安全性和有效性。分为对 HER2 阳性转移性乳腺癌患者单独使用赫赛汀以及与化疗一起使用赫赛汀。
- 1998 年 3 月 Genentech 公司宣布与诊断公司 Dako 合作开发商业测试确诊过度表达 HER2 的患者。
- 1998 年 5 月 Genentech 向 FDA 提出申请将赫赛汀投入市场。FDA 认为赫赛汀填补了一个对于恶性肿瘤治疗的医疗空白,为其打开「绿色通道「进行「优先审核」,审核将在接下来六个月进行而不是按标准程序等 10 个月。
- 1998 年 9 月 FDA 批准了赫赛汀对于 HER2 阳性转移性乳腺癌的治疗,并批准了一项诊断测试以帮助确诊病人。
- 2000 年 8 月 欧洲批准了赫赛汀。
- 2006-2008 年 FDA 批准了三类不同的基于赫赛汀的早期 HER2 阳性乳腺癌术后治疗方案。紧接着品准了赫赛汀对于胃癌的治疗。
- 2014 年 赫赛汀的第一个专利在欧洲到期。印度生物科技公司于 2013 年获批了一个高度类似的药物。在其带领下,一个韩国公司也获得批准了一类相似药物。该药物研究显示与原始药物相比,未出现任何关于安全或者药效的临床性差别。紧接着亚洲的一些药物获得批准。
- 2015 年 5 月 奥巴马总统宣布了 2.15 亿美元精准医疗研究项目后不久,世界卫生组织将赫赛汀加入中低收入国家的基本药物清单。
- 2019 年 预计赫赛汀的首个专利在美国到期,到时将有望大幅降低治疗成本。
基因数据全球化变局
一家着眼于亚洲市场的初创公司正致力于让更多的人惠享「精准医疗」带来的变革。
结肠癌在美国的发病率要高于印度。然而,它却更容易在印度年轻人群中肆虐,且一旦患病就来势汹汹。
关于结肠癌的大部分已知文献都来自西方世界。通过与西方患者携带的癌细胞比对,我们发现结肠癌细胞在印度有明显的基因突变迹象。
印度普遍的素食主义或许可以解释这一统计结果,但是却无法解释为何多数患者在年轻时发病。
医生们怀疑,是基因的不同导致了结肠癌细胞在这两个群体中的不同表现。一家名为「国际基因(Global Gene Corp)」的公司计划开展针对印度结肠癌患者的基因研究,期待能找出基因和患病间的联系,以及更好的治疗方法。
该公司将分析患者的 DNA 和癌细胞的基因组序列,用相应的算法为个人和群体提供治疗方案。收集到的数据还将帮助制药公司研制新药,制定相关策略。
该项目提供的测试不仅可以帮助诊断和预测一个人是否为病毒携带者、是否具有某种疾病的遗传倾向,还可以为患者提供最佳的药物选择和对应的最佳剂量。
在众多基因学难题中,国际基因公司希望破解的是,为什么尽管印度人的肥胖指数低于西方人,他们患糖尿病和其它肥胖相关疾病的概率却高于西方人群。
2013 年,国际基因公司成立于波士顿,其总部位于新加坡。当时两位来自哈佛医学院的医生加入公司高管团队,推动通过基因研究来改善发展中国家的医疗水平。
印度拥有庞大的人口数量,但在基因相关领域的前进却极其缓慢,在 2003 年才有了第一例人类基因测序。据该公司统计,尽管印度拥有世界 20% 的人口,其基因数据只占全球的不足 0.2%。
同样的情况也发生在世界上别的很多地方。该公司统计得出结论:除美国、欧洲、日本以外的国家占到世界总人口的 60%,但是对应的已测定基因组序列只占不到 1%。
这种情况主要是因为这些地区历史上只关注传染性疾病的管控和根除,并没有建立类似于美国的「人类基因组计划」和英国的「基因英国计划」。
国际基因公司从这一缺口中看到了巨大的商机。公司高管认为,如果考虑到人口预测、癌症数据统计和药学研究等方面,基因信息在印度市场的估值可以达到 19 亿美元。
如果加上中国、东南亚和中东等公司计划扩张的区域,这一估值将达到 81 亿美元,并可以保持 14% 的年增长率。
国际基因公司作为一家封闭性控股公司并没有公布自己的财政收入,但是它已经成功募集了多家私人基金,并且与欧洲、亚洲多达 48 家的商业、政府和科研机构建立了合作关系,并将自己的研发部门设立在了威康信托基金会桑格研究所的英格兰剑桥校区。该研究所曾经在人类基因组测序中发挥了巨大的作用。
国际基因公司在患者同意的情况下收集了超过 1 万组基因样本,建立起了印度最大的基因「生物银行」,并且发布了印度人的参考基因组(基于数学统计的「一般性」基因)。该公司宣称,这一参考基因组将有助于加深对印度多种疾病的理解。
为什么需要研究印度基因?国际基因公司称,印度人的各个民族几千年前起源于同一祖先,并且与别国人种明显不同。
这意味着有些基因片段是所有印度人共有的。通过与其他民族基因的比对,我们可以清楚的理解为什么有些民族对某些特定疾病具有倾向性。
因此,建立参考基因将有助于疾病管控、患者治疗和医疗发展。
举例而言,新加坡南洋理工大学环境生命科学中心的生物学教授、研究负责人斯蒂芬·舒斯特(Stephan Schuster)的研究表明,从基因学角度来讲,日本主要有三个民族。
此前尝试记录人类基因变异的工程并没有很好的将南亚地区包含在内。例如 2008 年至 2015 年间实施的「基因组计划 1000」仅仅包含了古吉拉特印度人和旁遮普巴基斯坦人在内的有限几个南亚民族。
在这之前的「国际人类基因组单体型计划」旨在建立人类基因组中常见的遗传多态位点目录,但遗憾的是,该计划也只包含了古吉拉特印度人这一个民族。
政府主导的基因工程往往可以有更多的成效。「基因英国」包含的「10 万基因计划」专项测序和收集罕见疾病和癌症患者的基因,并通过记录患者的种族来分析其与所患疾病间的关系。
在美国,奥巴马总统推行的「精准医疗」计划将于今年晚些时候开始实施。该计划将在提供医疗服务的同时收集民族信息,并以此来帮助研究人员更好理解健康和疾病领域的个体差异。
类似的大型基因地图计划往往因为收集不到足够多的基因数据,而无法得到具有意义的结论。国际基因公司努力通过数据来源的多样化来解决这一问题,这些来源包括合作医院、研究计划,以及做过基因测试并且自愿分享结果的个人。
宾夕法尼亚大学沃顿商学院的健康管理教授劳顿·R·伯恩斯(LawtonR. Burns)写过一些关于中国和印度的出版物。他指出,在这些国家,成本是制约基因发展的主要原因。
他估计,只要 25% 的印度人有医疗保险,且大多数医疗保险计划不涵盖基因检测。伯恩斯说:「要解决这一问题,首先人们要有了解自己基因组成的意愿,其次测试费用应该包含在健康保险中。只有这样,人们才愿意去花钱。」
国际基因公司的临床测试费用在 75 ~ 538 美元之间,而盖洛普(美国调查咨询公司)的调查显示,印度 2013 年的人均收入只有 616 美元。伯恩斯还提到,即使人们愿意为基因测试买单,这些基因信息又有什么用呢?
如何有效利用这些基因信息正是国际基因公司试图去解决。该公司的一项专利技术可以识别测试结果中在印度人群中常见的变异基因,并以此来区分非致病和致病基因突变。
将上述技术和软件相结合,我们就可以用其来判断一个人是否会因为服用他汀类降胆固醇药物而引发致命性并发症。例如,因为 BRCA1 和 BRCA2 这两种基因变异会导致乳房癌和卵巢癌的发病率突增,我们可以通过检测 BRCA1 和 BRCA2 基因给予受测者相应的建议。制药公司也可以利用特定的基因特征来研发新药。
国际基因公司的共同创始人乔纳森·匹克(Jonathan Picker)是哈佛医学院的基因学专家。他表示:「要改变人类的健康现状,就必须有全球化的基因数据;仅仅测定了有限的几个子集,绝对不能说我们已经真正了解了地球上的每一个人类个体。」
「医疗自拍」的时代即将来临!
心脏病专家、基因医学教授埃里克·托波尔向人们介绍「医疗自拍」的未来。
埃里克·托波尔就职于美国斯克利普斯研究所,是一名著名的心脏病专家、基因医学教授。他极力推崇通过 DNA 分析和数字技术来为患者提供差异化服务。他已经广泛地将这些技术应用在自己的患者身上,同时还为包括 Illumina 和 Gilead Sciences 在内的公司提供咨询服务。
不仅如此,埃里克还通过 Twitter 向对这一话题感兴趣的读者分享自己的心得体会。众所周知,个人基因组测序在当下已经说不上是昂贵。
据此,埃里克在他的《颠覆医疗》一书中说道,如果可以将个人基因测序和无线通信技术相结合的话,必然可以带来更加有效、更加个性化的医疗服务。
埃里克在加利福尼亚的拉霍亚接受了麻省理工科技评论资深编辑纳内特·伯恩斯的电话采访,以下是采访纪实:
 问:您提到,通过手机等电子设备来追踪健康数据,是实现医疗私人化、个性化的有效途径。
问:您提到,通过手机等电子设备来追踪健康数据,是实现医疗私人化、个性化的有效途径。
答:现在有很多智能设备,可以同步地、不间断地测量诸如血压、心率和血糖等多项身体指标。我们现在完全可以通过一部智能手机来完成患者的高分辨率全身超声检查,而不需要让他们负担高达 800-1000 美元的常规超声检测费用,并且我们可以实时将超声检测的结果分享给患者。
只需要一部智能手机,你可以给孩子做一个耳朵检查,你可以不需要眼科大夫就轻松完成一次眼睛检查,你甚至可以实时监测帕金森患者的震颤、声音及步态,并以此来判断其是否需要进药及需要服用的剂量。毫无疑问,我们正在步入「自我诊断」、「医疗自拍」的年代。
遗憾的是,很多人对「自我监测」的认识,还只停留在诸如 Fitbit(开发智能手环)和计步器之类的简单概念上。
问:正向您指出的一样,智能健康设备的发展和另外一个看似毫不相关的科技——基因医疗,联系在了一起。
答:众所周知,基因测序的成本已经显著的下降。然而,基于基因分析的药物却贵的离谱,而且往往只针对有限的疾病。如果我们可以通过基因编辑来治疗疾病,那么问题的本质其实在于它的成本。我们会问,与那些昂贵的高风险长期治疗相比、基因编辑治疗的优势是什么?
问:您积极的推动这一技术的发展。但是您对这种新型医疗有任何疑虑或者担心吗?
答:最大的顾虑是安全问题。我们的医疗数据正在不经意间被买卖、被窃取和破坏。去年,有超过 1 亿美国人的医疗记录被黑客获取,然后与其相对的是,只有大约 500 万人在线访问过他们自己的医疗记录,不得不说这是一个巨大的隐患。
每时每刻人们都通过自己的智能设备产生着新的数据,可是他们却不曾真正拥有这些属于自己的数据。医疗界并不情愿为这些庞大的数据提供存储空间,但是我们却不得不接受数字化时代下患者的这一属性变化。
问:有效利用这些数据很困难吗?
答:这其实也是我接下来想要讨论的问题,如何通过人工智能和深度学习来处理这些庞大的数据。其实在这一领域,我们远没有预想中走的那么远。要解决这一瓶颈,我们必须要能够通过相应的算法对数据进行实时处理,并将其迅速反馈给患者。
目前,很多公司正在开发这一技术:先通过传感器和图像技术捕获数据,再交由机器进行深度学习和预测分析,最后给予患者个性化的指导建议。
问:您认为要解决这些挑战需要多长时间?
答:我个人经常会有些不切实际,当然希望越快解决越好。但我也不得不承认,这是一个需要时间的过程。
科研和资本的一场豪赌
成功筹到数百万美元,Editas 证明了投资人对基因编辑技术的热情。现在,这家公司需要让自己的技术投入实际应用。
去年 1 月,在纽约市中心一家酒店的宴会厅里,卡特琳·波斯丽(KatrineBosley)与来自华尔街的投资银行家们听到了股市上传来的令人忧心的消息。
自去 12 月初起便一直下跌的股指继续下挫,而她所在的生物科技领域更是遭受重创。对于以科技股为主的纳斯达克来说,过去的一年是新股发行史上最糟糕的一段时间。但波斯丽却要说服满屋子的投资人逆势而动,相信她的公司 Editas Medicine 可以打破这种趋势。
Editas 的专长是使用一种叫做 CRISPR/Cas9 的技术进行基因编辑。与传统技术相比,CRISPR/Cas9 可以更准确、更容易地编辑 DNA。
因此,在发明后的四年时间里,它迅速在科学界流行了起来。Editas 正是由几位 CRISPR 技术的早期开发者创办的。现在,他们正设法将此工具应用于遗传疾病的治疗。
对于此类疾病,目前的技术手段几乎束手无策。Editas 正在研究针对眼科疾病、癌症、 镰状细胞性贫血和杜氏肌营养不良症等疾病的治疗手段。
在科学圈外,CRISPR 还远未得到广泛的了解。自 2014 年 6 月加入 Editas 后,波斯丽不得不花费大量时间,向风险资本和可能的投资者介绍公司的潜力。
即便如此,那家纽约酒店里的投资人仍然对这家公司充满疑问,甚至在 2 月份,Editas 非常成功地完成了首次公开募股,并筹到 1.09 亿美元之后,这些疑问依然存在。
这家公司目前没有任何产品销售收入,而且预计在可预见的未来也不会有。现有的 2 亿多美元现金可以维持公司两年的运转,但在这段时间内,他们必须创造出一款前所未有的产品。
而直到明年,他们才将会开展人体治疗试验。即便试验取得成功,商业化的时机也依然无法确定。
Editas 所拥有的优势,除了波斯丽和一支一流的科学家创始人团队之外,还有使用基因编辑从根本上改变医学的可能性。
 Editas 医学实验室的科学家珍妮佛·高利(Jennifer Gori)
Editas 医学实验室的科学家珍妮佛·高利(Jennifer Gori)
「这是一个非常强大的工具,」Deerfield Management 总经理吉姆·福林(Jim Flynn)表示。他的公司运营着包括 Editas 股份在内,高达 50 亿美元的医疗健康领域的投资。「这里的人们相信,如果 10 年后我们回望现在,将看到一条分界线:基因编辑出现前和出现后」。
作为 Editas 的两位联合创始人,乔治·彻奇(George Church)和张峰首先证实 CRISPR 可被应用于人体细胞的科学家。
在相关论文发表仅仅数月之后,三家在波士顿地区以医疗健康领域为重点的投资公司就设法说服了彻奇和张锋等人成立了 Editas,希望可以开发利用这种技术的商业可能性。
Editas 并不是唯一一家寻求开发基因编辑处理的公司。与 Editas 存在专利纠纷的竞争对手 Intellia Therapeutics,在 Editas 上市仅三个月之后也成功上市。
而在去年 12 月,拜耳则同意斥资 3.35 亿美元,与另一家公司一道成立了合资企业 CRISPR Therapeutics。
波斯丽表示,Editas 的研发进度一定赶得上在明年开展人体试验。他们计划向患有一种罕见眼科疾病的患者眼球内注入含有 Cas9 的病毒。这种疾病是由某一特定的基因突变造成的,会导致患者逐渐失明。注入的酶将剪切掉出错的基因序列,以触发一种细胞修复自身缺陷时 DNA 的自然反应。
Editas 以这种眼科疾病为切入点有着一些有利的因素,其遗传基础已被清楚了解,这种治疗也可以实现对目标部位的局部递送。
然而,重大的技术挑战仍然存在。Editas 必须确保治疗的有效性,到达病灶的过程要足够安全,对 DNA 的编辑也要正确,而且全部过程中不能产生任何有危险的副作用。
此外,关于 CRISPR 的一些潜在应用,依然存在伦理层面的质疑。该公司还要寄希望于这些质疑不会混淆对该技术的理解,从而导致监管部门延迟批准。
例如,一些科学家担心 CRISPR 会被用于设计人类胚胎。虽然 Editas 并不从事这方面的研究,但波斯丽仍然和法国国会议员、英国生物伦理学家等多个团体会面,讨论了这一议题以及其他方面的话题。
她表示,最拥护这一技术的是那些不治之症的患者,Editas 为他们带来了一线生机。对于他们来说,有效的基因编辑将可能是一项重大的医学突破。现在,波斯丽必须要证明,Editas 能够开发出这样的技术。
大规模制造 DNA 时代将提前降临
 George Church
George Church
一项制造人类基因计划的最大受益者,可能是位于麻省剑桥的一个称为 Gen9 的创业公司。
两个星期前,超过 130 多名基因研究领域科学家、伦理学家和政府官员在哈佛大学召开了闭门会议,讨论人类基因组计划的下一步行动——从读取转变为编辑基因信息。本次会议被命名为「人类基因组编码项目会议」(HGP Write),意图收集关于「通过人类基因组 60 亿个 DNA 碱基进行合成」的想法,其结果将用于制造新的细胞。
这一宏伟目标需要新技术以及海量的 DNA。「我们将成为实现这一目标的公司之一,」Gen9 的首席执行官凯文·门耐利(Kevin Munnelly)说道。
该公司从 2009 年开始生产 DNA 链,其创始人包括来自哈佛大学医学院的全球著名学者乔治·彻奇(George Church),人们评价他是「基因组写入计划」中十分具有远见的一名基因学家。「我们有 6 个技术人员,有 1400 平方米的工作空间,但没有任何组织能够凭此制造出这么多的 DNA。」
 马萨诸塞州剑桥的 Gen9 实验室里,机器人在注入液体
马萨诸塞州剑桥的 Gen9 实验室里,机器人在注入液体
分析人士表示,构建人类基因组所需的人造基因量将是目前全球年产量的三倍,也就是至少价值九千万美元的 DNA。
Gen9 到底什么来头?
如果你造访 Gen9 在麻省剑桥的实验区,真人比例的彻奇海报会立即抓住你的视线,上面写着「预测未来的最好方式就是去改变它。」这也许就是 Gen9 的信条——通过技术商业化使 DNA 更便宜。
彻奇表示,他希望在生物学领域做出英特尔之于电子领域的贡献。
目前,Gen9 主要是给制药公司以及先正达(Syngenta)这样的农业巨头提供精确的定制基因序列。这些基金序列被用于制造转基因植物或者细菌,从而生产例如人工胰岛素等药品。但这些由腺嘌呤、鸟嘌呤和胞嘧啶组成的基因序列的长度,通常只有一千个碱基对。
更便宜的 DNA 编码优化方案使得打印整个基因组成为可能。你想让微生物消耗二氧化碳同时产生燃料吗?总有一天,你也许通过选择、点击就搞定了。
除了乔治·彻奇,该公司的其他创始人(公司里都张贴了他们的等身肖像)有来自麻省理工学院的工程师乔·雅各布森(Joe Jacobson)以及斯坦福大学的人工合成生物学家德鲁·恩迪(Drew Endy)。「Gen9 就像他们的孩子,承载了他们的理念。这是他们一直以来的夙愿,」门耐利谈论到三位创始人时说,「公司的信条是通过简化过程、增强易用性,来推广合成生物学。」
打破基因编辑成本「摩尔定律」
大规模的 DNA 制造离我们越来越近,这要部分归功于 Gen9 的创新。在 2001 年,向基因序列中每添加一个碱基对的成本约为 12 美元。这项成本正在稳步降低,今年 4 月,Gen9 的报价已经低于 3 美分。(如下图)
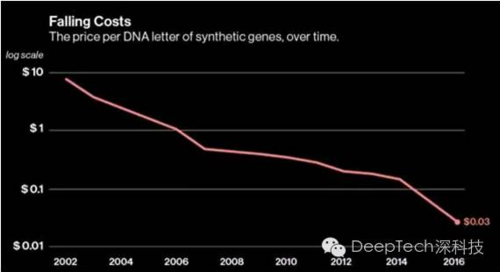
DNA 价格的下跌速度与计算机在摩尔定律下性能的稳步提升有类似之处。但如果想将基因编辑的成本降至基因读取的水平,还有很长一段路要走。按现在成本下降的速率,至少要等到 2066 年才有可能达到。这对两鬓已经斑白的彻奇来说是无法接受的,这也解释了为什么他说自己正在「近乎疯狂」的改进这项技术,希望打破基因编辑成本的「摩尔定律」。
但如果 DNA 的需求不能快速增长,价格的下降将带来经济困境。带我穿过装饰老旧的办公室时,门耐利说,许多公司的产能处于闲置状态。事实上,该产业的先驱——科登设备公司(Codon Device),就是因为 DNA 售价过低而损失了大笔资金,最终关门大吉。
秘密会晤
这就是一个雄心勃勃的,可能由政府资助的人类基因组项目的价值所在了:在促进 DNA 需求的同时,还能尽快催熟将 DNA 导入复杂的人类染色体中所需的相关技术。
「这将让人们清楚地看到市场的作用,」Gen9 的首席执行官凯文·门耐利说。「我想,如果确定发布这样的一个项目,技术开发者们将获得巨大的动力。」
概述合成基因组原理的提案已经由乔治·彻奇等人提交给学术期刊,很可能是《科学》杂志。彻奇说,在正式发表之前,他们希望人类基因组编码项目会议的内容暂时对外界保密。
但这一决定,遭到来自恩迪的强烈批评,身为联合创始人之一的恩迪,在一条推特中披露了部分会议流程。尽管恩迪拥有该公司股份,并强烈支持开发更好的 DNA 编辑工具,但他仍然撰写了一篇社论质疑对低成本 DNA 技术的追求,不需要站在道德制高点上,鼓吹创造人类基因组是一个「合理的需求驱动力」。他建议,科学家应该转而专注于打印细菌染色体。
有人指出,制造人类基因组可能带来一系列宗教和伦理问题。尽管目标还很遥远,但是理论上,我们已经可以在计算机上设计并制造人类,而这一切都不需要父母的参与。还有人说会议组织者在和创业公司公关方面做得还不够。
「这些公司将迎来巨大的盈利机会,简直是坐收渔利。」麻省理工学院林肯实验室(Lincoln Lab)的合成生物学家彼得·卡尔(Peter Carr)说道。
Gen9 已经开始向尚未发表论文的联合作者大量打折销售 DNA,包括来自纽约大学医学院的研究员杰夫·伯克(JefBoeke)。他领导的研究组希望用人造染色体来代替酵母细胞染色体。
乔治·彻奇在哈佛大学医学院的实验室也订购了数以百万计的碱基对,他们正试图修改大肠杆菌的遗传密码,这项工作也有待发表。
人类基因组编码项目会议的第三个组织者安德鲁·黑塞尔(Andrew Hessel),他是来自欧特克公司(Autodesk,三维计算机辅助设计软件公司)的未来学家。
据与会者表示,该公司赞助了在哈佛大学召开的会议。该公司不仅正在开发生物设计软件,还向各地的合成生物学实验室提供资金,并且与 Gen9 合作,向其购买 DNA。「再多说一句我就违反 Autodesk 保密协议了。」门耐利说道。
DNA 复兴
即使没有重大项目,DNA 合成产业爆发的可能性也已经吸引了大量投资者。一家名为 Twist Biosciences 的加州公司,已在过去的 18 个月里筹得超过 1.4 亿美元。乔治·彻奇说,他也是该公司的股东。
生产自动化导致 DNA 价格迅速下降。今年 4 月,Gen9 对大笔订单的每对碱基对定价仅为 3 美分。
Gen9 和 TwistBiosciences 已经采用了计算机工业的技术,大规模生产短链 DNA。比如,Twist 将这些短链 DNA 放进微加工硅片的细槽里。Gen9 则将它们缩印在玻璃载片上。最终它们将被剪切下来,重组、结合成长达一万个碱基对的基因片段。
新的大规模生产方式正在取代起源于 20 世纪 70 年代的高成本的传统基因制造技术。「合成工业在此刻复兴,这令人十分振奋,」Ginkgo Bioworks 的联合创始人之一杰森·凯利(JasonKelly)说。该公司今年向 Twist 订购了一亿个基因,这是该品类今年的最大订单。
Ginkgo 正在寻找制造有价值的香料及其他化学品的新方法。为此,它需要大量植物基因,以便插入酵母细胞进行测试,一般需要测试上千个变量,这就是为什么 DNA 的价格仍然是个问题。
他说,想象一下,用 1 和 0 的工作的计算机程序员,每次发送指令的时候要收他们 10 美分,这肯定会极大限制他们尝试运行指令的数量。「我们真正需要的是低成本制造大量单个基因的能力,」凯利说道,「这是我们的痛点,也是每个公司都想要的。」
不太明确的是,为什么会有人想要一个完整的合成基因组。「任何人工合成人类基因组的计划都将耗费好几年,甚至几十年,如果缺乏商业回报,项目将随时可能停滞不前,」行业顾问罗布·卡尔森(Rob Carlson)说道。如果没有经济动机,他不知道基因组编辑项目将如何变现。「目前商业生物技术中的 DNA 使用量,永远不能为大规模生产合成人类基因提供足够的需求。」
乔治·彻奇:请以包容的心态看待新兴技术
彻奇认为这个观点有失偏颇。「像 60 年代我们看待计算机行业一样,人们的固守成规将使我们陷入迷茫,」他说。「当你问别人是否需要个人电脑,他们会反问你,什么是『电脑』?那玩意儿可能有一个屋子那么大,却并没有什么用。」他们无法想象晶体管的未来将是「愤怒的小鸟」或是 Facebook。
彻奇说,工程师们明白,一切新技术都有广阔的改良空间。眼下,化学家需要三分钟来将一个碱基对写入 DNA,而细胞内的分子每秒就能写入 1000 个碱基对。人类细胞在 24 小时内就能建立一个新的基因组,而且基本上是免费的。
「这是人类的阶梯,」彻奇说。「每一个创新都将引领我们更接近目标。」





